実は、身の回りには科学であふれています。
世の中大半のことは科学で説明でき、科学がルールになっています。
何気なくやっていることも、聞かれてみるとあれ?ってなるような現象もたくさんあるはずです。
この記事を書いている私も、知らないことであふれつつも使いこなして生活していますが、そう考えるとちょっと不思議な気持ちになりますよね。
今回の記事では、科学というよりも化学ですが、水に溶けやすい物質をテーマに解説していきます。
水に溶けるっていざ聞かれるとどういう現象で何が起こっているのかってわからないものですよね。
理系の旧帝大学・大学院で研鑽・研究を経験し、現在は研究開発の仕事をしている私がわかりやすく解説していきます!
水に溶けやすい物質
「水に溶ける」という現象は皆さんご存知だと思いますし、経験もされていると思います。
水に塩を溶かして塩水にしたり、砂糖を溶かして砂糖水にしたり、経験ありますよね。
逆に、水に溶けないということも経験ありますよね。
油が水と分離しちゃう現象がそれですよね。
ドレッシングを毎回振るのも水と油なので、それをかき混ぜるためです。
でもあれは溶けているわけではないんです。
そうこう考えていくうちに、わけわかんなくなっちゃいますよね。
なので、まずは水に溶ける物質の具体例を紹介していきます。
水に溶ける物質さえわかればいいんじゃ!という方はこの次まで読めばOKです。
水に似たものは溶ける
結論ですが、水に溶ける物質とは、化学的に水に似たものです。
いやいや、水に似たものってなんやねん、と思う方も多いと思います。
少し難しい言葉になりますが、小さな極性物質、電解質、においのあるものこれらが水に溶けるのです。
これらのうちのどれかに当てはまれば、水に溶けるんだな~と考えていただければOKです。
具体例を挙げていきましょう。
小さな極性物質:水、アンモニア、エタノール、硫化水素、塩化水素など
電解質:塩化ナトリウム(食塩)、塩化銅、硫酸、塩化水素など
においのあるもの:アンモニア、果物などのにおいのもと、硫化水素など
ちょっと待って、アンモニアみたいにいろんなところで登場しているものもあるじゃん?なんで?と思うかもしれませんが、間違いではありません。
あくまでもざっくりした枠組みですので、どちらにも当てはまる物質もあります。
好きな食べ物は?と聞かれて、カレーが好きな人もいれば、ハンバーグが好きな人もいるし、両方好きな人もいますよね。
そんなイメージです。
水とは
いや、そんなこと言われても、この程度じゃ消化不良だよ!という方向けにもう少し詳しく解説していきますね。
具体例だけわかればいいや、という場合はここまでで問題ありません。
とはいいつつ、基本的に「水に似たものが水によく溶ける」ということは変わらないので、水について理解することは大事です。
ここで紹介する話以外にも水は不思議な性質を持っているので興味のある方はぜひ調べてみてください!
ここでは、水の極性について解説します。
水は2つの水素原子と1つの酸素分子でできています。
こんな感じに。
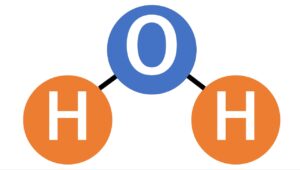
大事なのはここからです。
この原子の配置はしっかり決まっていて、一直線ではなく折れ曲がった形になっているんですよ。
だいたい110度よりも小さいくらいの角度です。
そこから生まれるのが「極性」です。
水は分子なのでプラスの電気もマイナスの電気も帯びていません。
でも、細かーく見てみると微妙に偏りがあるんですよ。
具体的言うと、水素側はちょっとプラスに偏っていて、酸素はちょっとだけマイナスに偏っています。
全体としてはプラスマイナスゼロだけど、ピンポイントで見たらちょっと電気的なアンバランスさがあるということです。
イメージで言えば、水素のところにすごーく弱いS極があって酸素のところにすごーく弱いN極があるようなイメージですね。
こういった分布を極性といい、水は極性分子になります。
水に似ているとは、比較的小さな極性分子ということです。
水に溶けるとはどういうことか
水に溶ける物質の具体例、分類、水の極性についてご理解いただけたところで、さらに掘り下げていきましょう。
溶けるとは
「水に溶ける」と表現されますが、そもそも「溶ける」ってどういうことか説明できますか?
パッと説明できる人は意外と少ないんですよ。
私も急に聞かれたら考えこんじゃうと思います。
溶けている状態とは、溶質がばらばらに引きはがされて、引きはがされた粒子の周りを溶媒が囲んでいる状態です。
このように溶けた状態を化学の世界では溶解といいます。
ちなみに、溶質とは溶媒に溶ける物質のことです。
食塩水を例に考えると、水は溶媒、食塩は溶質、食塩水は水溶液となりますね。
水に溶けるとは、溶媒が水の場合になりますね。
水和とは
水和とは、水に溶質が溶けている状態です。
具体例を見てみましょう。
砂糖を水に入れてみましょう。
砂糖は水の中で砂糖の分子ひとつひとつにばらばらになります。
このばらばらになった砂糖の分子の周りに水の分子がくっつきます。
砂糖の分子(=ばらばらに引きはがされた溶媒の粒子)を水の分子(=溶媒の分子)が囲んでいる状態ですね。
この状態が水和で、水に溶けている状態です。
水に溶けるために必要なもの
ここまでで水和についてお伝えしましたが、水和の状態になるためには必要なものがあります。
それは水に似ていること、すなわち極性のある物質であることです。
分子の構造的に極性があればそれで問題ないのですが、極性が無くても極性基があれば水に溶けることができます。
具体的には、水酸基、アミノ基、アルデヒド基などです。
分子の構造的に極性が無さそうでもこういった官能基があれば水に溶けることができます。
電解質は極性がある物質になりますが、そもそも「水に溶けて電気を流す物質」と定義されているので電解質である以上水には絶対に溶けます。
ちなみに、簡単な判別方法として冒頭でお伝えした「においがある」ということです。
においをどのように認識するかというと、鼻の中にある粘膜に溶けることで脳に信号が伝わります。
鼻の中にある粘膜に溶けるので、水に溶けない物質はにおいを感じることができません。
ですので、においのある物質は水に溶けるのです。
【例題】大学受験問題で考える水に溶けやすい物質とは
実は、水に溶けるかどうかは大学受験の問題になるくらい重要なテーマなんです。
大学受験の問題を少し簡単にしたので、こちらも見てみてください。
次のうち水に溶けやすい物質の組み合わせは?
① グルコースとヨウ素
② ナフタレンとヨウ素
③ 塩化ナトリウムとグルコース
④ ナフタレンと塩化ナトリウム
【解答・解説】
解答:③
グルコースは極性基である水酸基(-OH)をたくさん持つので水に溶けます。
ヨウ素は極性が無いので水に溶けません。
ナフタレンも極性分子なので水に溶けません。
塩化ナトリウムは極性もあり、電解質なので余裕で水に溶けます。
以上より、水に溶ける物質の組み合わせは③ですね。
【化学】水に溶けやすい物質まとめ
今回は水に溶ける物質は何かというテーマを解説しました。
水に溶ける物質は水に似ている物質でしたね。
もう少し掘り下げると、極性のある小さな物質、電解質、においのある物質になりますが、これらのどれかに当てはまれば水に溶けるものと判断してOKです。
また、「溶ける」という現象にも注目しましたね。
溶質をばらばらにして溶媒(水)がそれを取り囲んだ状態になることです。
もちろん、こういったことは知らなくても生きていけますが、ふとした疑問や当たり前に思っていることを掘り下げてみると思いもよらない発見があることもあります。
ですので、好奇心を忘れずにいろいろ調べてみてください。


